国际食品法典委员会
国际食品法典委员会(CAC)于 1981 年发布了《婴儿配方及特殊医用婴儿配方食品标准》(Codex Stan 72-1981),该标准的 B 部分专门针对特殊医学用途婴儿配方食品,规定其营养成分应以正常婴儿配方食品的要求为基础,根据疾病状况进行调整。另外,CAC 又在 1991 年发布了《特殊医学用途配方食品标签和声称法典标准》(Codex Stan 180-1991),主要对特殊医学用途配方食品(Foods for Special Medical Purpose,FSMP)的定义和标签标识进行了详细规定。
CAC 对特殊医学用途配方食品的定义为“特殊医用食品是指为病人进行膳食管理并仅能在医生监督下使用的,经特殊加工或配制的用于特殊膳食的一类食品。这种食品是为那些对普通食品或其中的某些营养素在进食、消化、吸收或代谢方面受限或有障碍的病人,或因病情有其他特殊的营养需求的人,或者其膳食不能仅通过改善正常膳食而必须使用特殊膳食或与两者结合而进行管理的人,而使用的一类食品”。定义明确了该产品是一类食品,以及其目标人群、作用和使用方法。
欧盟
1999 年,欧盟正式颁布了特殊医学用途配方食品标准(1999/21/EC),将特医食品定义为“用于病人膳食管理,具有特殊营养用途的加工或配方食品,需在医生监护下使用”,并将该类产品分为三类:全营养标准配方食品、针对某种疾病或临床要求的全营养特定配方食品和非全营养标准配方或特定配方食品。除此之外,欧盟还出台了一系列文件规定了特医食品中食品添加剂标准、微生物限量和相应标签标识规范。
美国
在美国,特殊医学用途配方食品被称为医用食品(Medical Foods)。1988 年,美国首次在药品法修订版(Orphan Drug Act Amendments)中对医用食品进行了明确定义,医用食品是“用于特殊疾病或状态下的膳食管理,为满足特定营养需求,且基于公认的科学原则并建立在医学评估基础上的用于肠内的配方食物,其使用需要在医生的监护下进行”。
此外,医用食品主要分为四类:全营养配方、非全营养配方(包括组件类产品)、用于 1岁以上的代谢紊乱病人的配方食品和口服的补水产品。同在 1988 年,美国食品药品监督管理局(FDA)首次出台了对医用食品的生产和监管的指导原则,包括生产、抽样、检验和判定等多项规定,拟添加在特殊医学用途配方食品中的新成分/新原料需要进行 GRAS评估,不需要上市前的注册和批准。
澳大利亚和新西兰
2012 年 6 月,澳新食品标准局(FSANZ)发布了关于特殊医学用途配方食品的相关标准(Standard 2.9.5),并于 2014 年 6 月起正式实施。该标准主要规定了特殊医学用途配方食品的定义、销售、营养素含量以及标签标识等四部分内容,其产品定义基本上等同采用了 CAC 标准中的定义,标签标识中也强调了要标识产品的营养成分及含量、渗透压,在医生或营养师指导下使用等信息。
日本
在日本,特殊医学用途配方食品被称为病人用食品(Food for Sick)。2002 年,日本健康增进法(第 103 号法律)第 26 条确定了特殊医学用途配方食品的法律地位,病人用特殊食品上市前需要通过日本厚生省批准。对于病人用标准配方食品,日本厚生省根据每类病人用特殊食品的许可标准对所申报产品配方进行审核批准,许可标准中对于各种营养素的限量进行了明确规定,时间短,程序简单。需要个别审批的食品,厚生省对于所申报产品进行全面的技术审评和批准,时间长,审批流程复杂。

中国
1规范+2产品国标已形成,启动特医食品快速发展
在我国,国家最早发布的特殊医学用途配方食品方面的政策文件是《特殊医学用途婴儿配方食品通则》(GB25596-2010),该项食品安全国家标准由原卫生部在 2010 年 12 月 21日正式对外发布,自 2012 年 1 月 1 日起正式实施,从此启动了我国特医食品产业快速发展的按钮。2013 年 12 月 26 日,国家卫生和计划生育委员会又一同发布了有关特医食品的 3 项食品安全国家标准,分别是《特殊医学用途配方食品通则》(GB29922-2013)、《特殊医学用途配方食品良好生产规范》(GB29923-2013)以及《预包装特殊膳食用食品标签》(GB13432-2013),自此我国已经建立起来了与国际接轨的 1 个生产规范+2 个产品通则的食品安全国家标准管理模式。
特医食品纳入新《食品安全法》,法律地位明确
2015 年 10 月 1 日起正式实施的新修订《中华人民共和国食品安全法》将保健食品、特殊医学用途配方食品和婴幼儿配方食品一起纳入“特殊食品”实行严格监督管理,明确了特医食品的法律地位,并明确由国务院食品药品监督管理部门对特医食品实行注册制管理,注册时应当提交产品配方、生产工艺、标签、说明书以及表明产品安全性、营养充足性和特殊医学用途临床效果的材料。
特医食品注册管理办法出台,激活特医食品市场
2016 年 3 月 10 日,国家食品药品监督管理总局正式公布了《特殊医学用途配方食品注册管理办法》,并于 2016 年 7 月 1 日起实施。该办法的正式实施将激活国内特医食品市场,产业也将迎来蓬勃发展的新机遇。之前由于我国特医食品的普及率没有欧美等发达国家高,处于发展初期,但政策的逐步完善成为了推动国内特医食品市场发展的催化剂。完善的国家产业政策将对充满潜力的特医食品市场实现规范与引导,国内全新的特医食品蓝海正在开启,属于特医食品的春天即将到来。


我国特医食品市场机遇较大,但产品监管将十分严格
我国特医食品市场增速较高,仍未满足国内需求
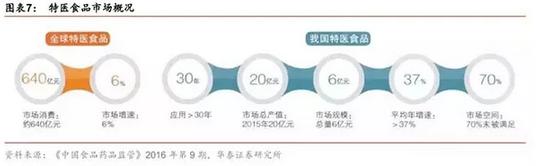
全球特医食品产业已经进入稳步发展期,近年来以6%的增速增长,2015 年全球特医食产品市场规模约 640 亿元。中国特医食品近几年发展迅猛,北京怡生安康生物科技有限公司发布的特医食品调研报告指出,国内特殊医学用途配方食品市场的总产值已从 2004 年的1.2 亿元增加到了 2015 年的 20 亿元。虽然我国特医食行业发展迅速,但与发达国家相比仍有很大差距,在美国,有 65%的营养不良患者在使用特医食品,英国有 27%,而中国大陆只有 1.6%。根据《中国食品药品监管》显示,我国至少还有 70%的特医食品需求没有得到满足。随着中国老龄化社会逼近,以及人们对临床营养需求的不断增加,特医食品产业将迎来较大发展机遇。
特医食品监管严格,研发、生产、检验门槛要求较高
2016 年 8 月,由国家食品药品监督管理总局指导,中国营养保健食品协会主办的中国特殊医学用途配方食品宣贯大会在北京召开。大会上,国家食品药品监督管理总局副局长滕佳材强调,特殊医学用途配方食品是给予特殊人群特定疾病状态下的营养支持与保障,其涉及种类较多、组份较多、工艺复杂,质量安全直接影响到目标人群的健康安全,须臾不得放松。特医食品行业和企业要重视自律与规范发展,落实质量安全主体责任、严格按照法律法规和制度要求,做好生产经营工作。
在宣贯大会上,中国营养保健食品协会成立了特殊医学用途配方食品应用委员会。该委员会由 69 位医学及营养专家组成,将建立一个从基础研究到临床应用的多学科专家团队,促进特医食品在基础研究、配方设计、研发生产、临床试验和流通应用等方面的有效性、安全性和规范化,协助政府管理部门在政策制定、技术支撑和教育宣传方面的工作。另外,国家食品药品监督管理总局还将成立注册司,专门负责特医食品注册。作为特医食品安全的守门关——注册司的门槛非常高,对生产企业的研发能力、生产能力、检验能力提出了较高要求,将严格申请人资质条件、严格审评审批程序、严格标签标志、严格临床试验、严格监督检查和严格法律责任。


